|
|
|
■心臓カテーテル検査
■冠血流予備量比(FFR) 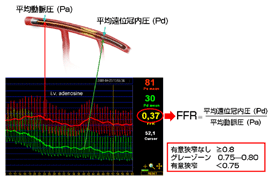
拡大画像を別ウィンドウで表示 
■心臓カテーテル治療
■ステントを留置した部位の血管内超音波と光干渉断層法で観察した画像
|
 心臓カテーテル検査 心臓カテーテル検査
心臓カテーテル検査は、手首や肘または足の付け根の動脈や静脈から管(カテーテル)を挿入し、心臓を養っている冠動脈を造影したり、心臓内の圧や酸素量の測定などを行う検査です。当院では年間約1500件の検査を毎日行っております。
冠動脈造影は、動脈から挿入したカテーテルの先端を冠動脈の入り口へ誘導し、手元から造影剤をカテーテル内に注入しながら、連続的にX線撮影を行います。造影剤を流すことで、動脈硬化によって冠動脈の狭窄している部分を見つけることができます。この検査で異常が見つかった場合は、薬による治療を行うのか、ステントを用いる冠動脈形成術を行うのか、冠動脈と大動脈のバイパス手術を行うのかを決定することができます。
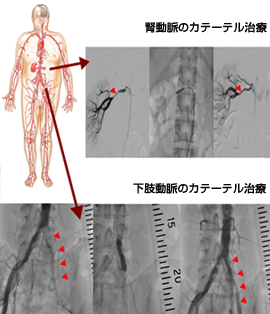
左室造影はカテーテルを大動脈から逆行性に左心室内に進め、左心室の圧を測定したのち、造影剤を注入してX線撮影を行います。右心カテーテル検査では、先端に風船がついた特殊なカテーテルを用いて、静脈から挿入したカテーテルを右心房から肺動脈まで運びます。この間それぞれの場所で圧を測定することにより、心不全の程度の診断などを行うことができます。また先天性の心臓病の方に対して、血液中の酸素量を調べることにより、病気の重症度を診断することができます。当院では、その他、大動脈の狭窄や大動脈瘤の程度を検索する目的で行う大動脈造影や末梢血管の閉塞性動脈硬化症の精査目的で末梢動脈造影も行っています。
近年、冠動脈内に狭窄病変があるとき、狭窄病変によってどのくらい血流が阻害されているかを推測する指標として、冠血流予備量比(FFR)を使用しています。FFRとは労作時に近い冠動脈血流を作り、その時の狭窄の前後での圧を測定し、その狭窄が狭心症に関与するかどうか判断する方法です。FFRは、通常心臓カテーテル検査に続いて行い、冠動脈拡張剤(ATP:アデノシン)を点滴投与しながら、プレッシャーワイヤーという装置を冠動脈に挿入して測定します。
 カテーテル治療 カテーテル治療
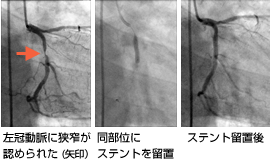
カテーテル治療とは、冠動脈や下肢動脈の細くなったり、閉塞している部位を広げる治療です。治療には主に、バルーンによる拡張、ステント留置術、ロータブレータ治療、血栓吸引治療などがあります。当院では年間約400件の心臓カテーテル治療を行っております。具体的には、まず狭窄のある病変部位にガイドワイヤーという先端の柔らかい針金を通過させ、そのワイヤーに沿って風船つきのカテーテルを病変部分まで挿入します。病変部位で風船を膨らますことにより、病変部位が拡張できます。さらにより確実に拡張するために金属を網目状に加工したステントという器具を用いることが多くなっています。
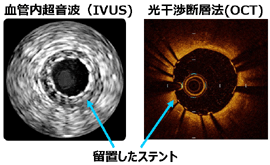
ステントは、さらに、最近ではステントに抗がん剤や免疫抑制剤を塗った薬剤溶出性ステントを使用することもあります。病変部位の石灰化が強い場合、バルーンやステントでは拡張しにくく、ロータブレーターと呼ばれるダイヤモンドチップが先端に付着したドリルを高速で回転させ、硬い病変部位を削り取る治療もあります。急性心筋梗塞のように血管内に血栓が多い場合には、特殊なカテーテルを用いて血栓を吸い取る、血栓吸引療法を行います。また、治療器具の選択や治療効果の判定のために血管内超音波、血管内視鏡、光干渉断層法を併用したり、センサー付きガイドワイヤーを用いて冠動脈血流速や冠動脈内圧の測定などを積極的に行っています。
|
|
■エキシマレーザー冠動脈形成術(ELCA) 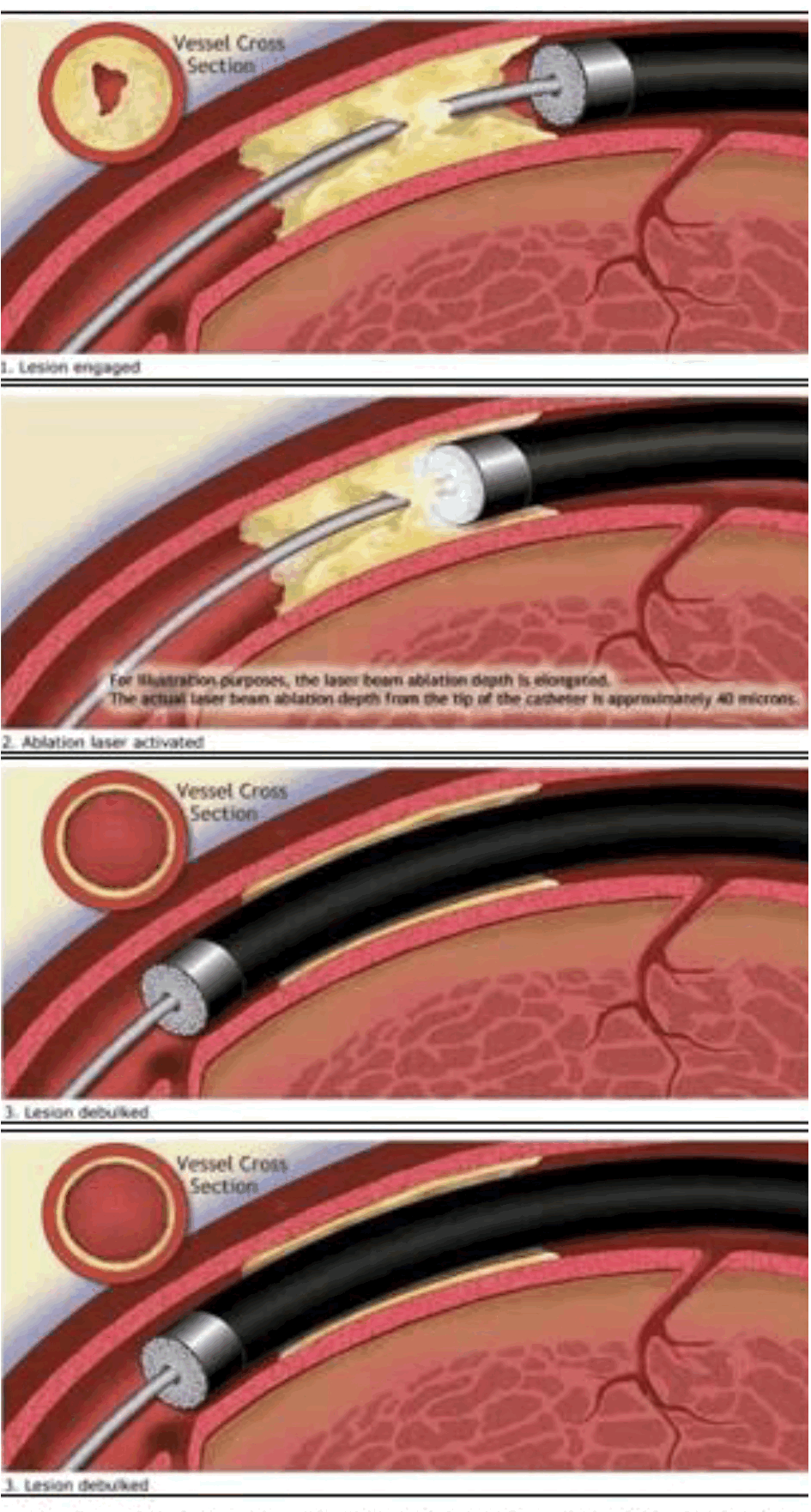 |
 エキシマレーザー冠動脈形成術(ELCA) エキシマレーザー冠動脈形成術(ELCA)
エキシマレーザ冠動脈形成術(ELCA)とは、冠動脈に挿入されたカテーテルの先端から照射されるエキシマレーザによって、閉塞した血管を開通させるという治療方法です。この方法は生体組織に熱損傷を起こすことなく病変組織を蒸散(すなわち、組織除去)させる事ができる唯一の方法です。レーザー治療を行った後、バルーンカテーテルなどを使って血管をさらに広げる治療を行います。従来の心臓カテーテル治療に難渋する、多量の血栓を含む急性心筋梗塞の病変、ステント再狭窄病変また、急性心筋梗塞に起きる新規血栓形成の抑制も期待されます。日本では2012年5月からようやく保険償還されることになり、当施設でも2023年から使用可能となりました。
|
|
■図1経皮的中隔心筋焼灼術 (PTSMA) 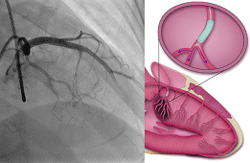
■図2 治療前後の大動脈と左室の圧格差 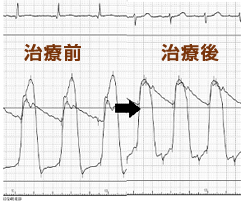 |
 経皮的中隔心筋焼灼術 (PTSMA) 経皮的中隔心筋焼灼術 (PTSMA)
原発性の心室肥大をきたす肥大型心筋症のなかでも、一般に、左室内圧較差が30mmHg以上残存する閉塞性肥大型心筋症では、その予後は不良とされています。無症状の場合もありますが、多くは心臓に関連する症状を有しており、労作時の息切れ、胸痛、呼吸困難、動悸、眼前暗黒感、失神などが挙げられます。症状がある場合は治療が必要となり、突然死の原因となるため慎重な経過観察が必要です。しかし、十分な薬物療法下にもかかわらず、左室内圧較差が残存し、息切れなどの心不全症状をきたす症例も少なくなく、その場合には、非薬物治療である外科的中隔心筋切除術やペースメーカ植込み術、経皮的中隔心筋焼灼術 (PTSMA)を検討します。カテーテル治療であるPTSMAは1990年代にはじまり、手法が次第に確立されるともに、その成績は向上するようになり、いまでは外科治療と同様に第一選択として考えられるようになりました。侵襲が少なく、高齢者や併存疾患の多い症例などでは非常に良い適応と考えられています。PTSMAはおもに左室流出路閉塞型のHOCMを対象とし、肥大心筋を栄養している中隔枝にバルーンカテーテルを通して選択的に高濃度エタノールを注入し (図 1) 、心筋に凝固壊死を起こすことで左室流出路狭窄を解除し、圧較差が改善します (図 2)。
|
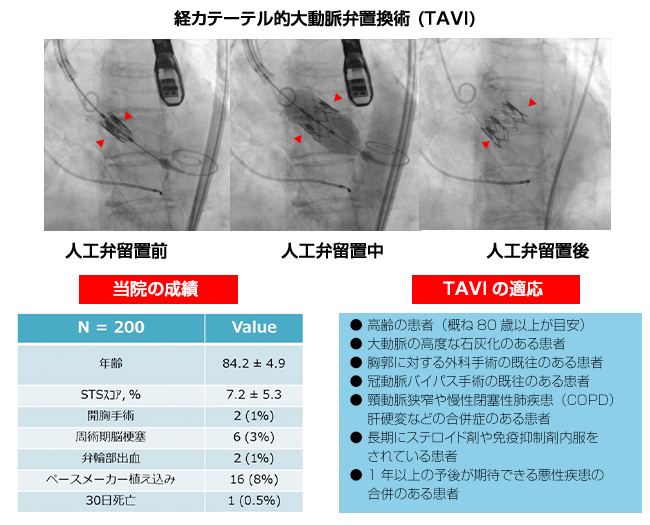
 経カテーテル的大動脈弁置換 (Transcatheter Aortic Valve Implantation)TAVI 経カテーテル的大動脈弁置換 (Transcatheter Aortic Valve Implantation)TAVI
近年、超高齢化時代に突入し、心臓弁膜症の潜在患者数増加の一途をたどっていますが、弁膜症の中で、最も急増しているのが、大動脈弁狭窄症です。重症の大動脈弁狭窄症は、胸痛、息切れ、失神などの症状がでると数年で死に到る進行性の病気で、従来、外科的人工弁置換術(手術)が唯一の延命効果のある治療とされていました。しかし、心臓外科手術が必要となった患者さんにおいて、手術リスクが高い場合(高齢の方、心臓の開心手術を過去に行った事がある方、全身状態が良くない方、体力の低下を認める方)、手術による治療を断念するケースが少なくありませんでした。
「TAVI」とは、「経カテーテル大動脈弁治療(Transcatheter Aortic Valve Implantation)」、略して「TAVI」と呼ばれます。胸を開かずまた、心臓を止めることなく、「人工弁」を患者さんの心臓に装着することができる治療法です。2002年にフランスで初めて治療応用に成功し、世界では欧米を中心に25万例近い治療が行われています。日本においても、2013年10月より 公的保健の適用が認められたことでTAVIによる治療が可能となり、当院も2016年4月開始し、2021年3月までに259例に達し、大きな合併症なく良好な成績を収めています。日本における現時点のTAVI治療の適応を図に示します。これまで、概ね80歳以上の高リスクな症例がTAVIの適応でしたが、最近は、二尖弁や僧帽弁置換術後の症例にもTAVIを行っています。海外ではすでに、中等度リスクや低リスク症例のTAVIについて多くの臨床治験が施行され、今後ますます適応の拡大が予想されます。
TAVIチームは、循環器内科・心臓血管外科だけではなく、麻酔科・中央臨床工学部・看護部・中央放射線部などの関連部門で構成され、毎週火曜日には「ASカンファレンス」を開催して、知識の向上、患者情報の共有に努めています。
今後、当院でTAVI治療が行えることにより、これまでの治療(経過観察または内科的治療、外科的治療(大動脈弁置換術)に、TAVI治療という選択肢が増えることになり、患者さんにとって より適切な治療を選択することができ、大きな福音になると考えています。
◆ 金曜日午後にTAVI外来を開設しております。外来へご紹介は地域連携室へご連絡ください。
◆ 医師への相談は下記メールアドレスへご連絡ください。
循環器内科 TAVI外来 ocgh.tavi.shoukai@gmail.com
|
当施設にて2023年4月より透析症例へのTAVIが可能となりました。
これまで維持透析症例の大動脈弁狭窄症に対するTAVIについては、そもそも透析症例における生体弁の構造劣化が早いことが示されていること、著しい石灰化があることなどにより成績が不良であることが予測され,禁忌とされていました。しかし、治験にて一定の有効性と安全性が示されたため、2021年1月よりTAVIが施行可能となりました。当院でも2023年4月より施行可能となりましたので、適応となる症例があれば、ご紹介をお願いいたします。
|
|
■TAVIチーム
|
 TAVIチームについて TAVIチームについて
TAVIチームは、循環器内科・心臓血管外科だけではなく、麻酔科・中央臨床工学部・看護部・中央放射線部などの関連部門で構成され、毎週木曜日には「ASカンファレンス」を開催して、知識の向上、患者情報の共有に努めています。
今後、当院でTAVI治療が行えることにより、これまでの治療(経過観察または内科的治療、外科的治療(大動脈弁置換術)、PTAV(経皮的大動脈弁形成術)に、TAVI治療という選択肢が増えることになり、患者さんにとってより適切な治療を選択することができ、大きな福音になると考えています。 |
 経皮的僧帽弁接合不全修復術(MitraClip) 経皮的僧帽弁接合不全修復術(MitraClip)
一般的に僧帽弁閉鎖不全に対しては僧帽弁形成術や人工弁置換術が行われていますが、いずれも人工心肺を必要とする外科手術です。 経皮的僧帽弁接合不全修復術(MitraClip: マイトラクリップ)は高齢者や心臓以外の合併症のため外科手術の危険性が高い、または向いていない患者さんに向けた、カテーテルを用いる新しい治療法です。
MitraClip は全身麻酔下に大腿静脈から挿入したカテーテルを用いて行います。 経食道心エコーでモニターしながら、下大静脈から心房中隔を経由し左房にアプローチを行い、クリップという器具で逆流の原因となっている部位を修復します。 クリップで僧帽弁を閉じるという治療の性質上、僧帽弁の形態によってMitraClip の治療自体が困難な患者さんもおられます。
|
 僧帽弁閉鎖不全 僧帽弁閉鎖不全
様々な原因により僧帽弁が完全に閉じなくなり、左心室が収縮した際に血液が左心室から左心房に逆流してしまう状態です。 重症になると労作時の息切れや浮腫などの心不全症状が出現します。 心不全症状を伴う重症僧帽弁閉鎖不全は治療の適応になります。
|
|
全身状態の評価とともに心エコーで僧帽弁の形態評価を行い、循環器内科医、心臓血管外科医、麻酔科医などの多職種からなるHeart teamで議論し、MitraClipの適応について決定します。 症状や心雑音などから対象もしれないと思われる患者さんがおられましたら、まずは適応について検討させていただきますので、是非ご紹介をお願いいたします。
|
 不整脈診療について 不整脈診療について
不整脈とは 正常の状態では、心臓は規則正しく拍動するように調整されています。この規則正しい拍動調整ができなくなった状態が不整脈という状態になります。
不整脈を大きく分類すると、脈が遅くなる不整脈(徐脈性不整脈)、脈が速くなる不整脈(頻脈性不整脈)、脈のリズムがくずれる不整脈に分類され、それぞれについて必要に応じて治療が行われます。
徐脈性不整脈によって倦怠感、体のむくみや呼吸困難などが出てきた場合や、突然心臓が止まってしまい、めまいや意識消失などをおこしてしまう場合には、ペースメーカーという機械が必要になります。このペースメーカーには電気刺激により心臓を規則正しく拍動させる機能があります。
頻脈性不整脈によって、動悸感、疲労感、息苦しさ、めまい・ふらつきといった症状がみられる場合には治療が必要となります。上室性(心房性)不整脈に対しては薬物治療やカテーテルアブレーションによる治療を行い、心室性不整脈に対しては薬物、アブレーションに加え、植込み型除細動器(ICD)が適応となる場合があります。
カテーテルアブレーションとは
足の付け根などからカテーテルを心臓に挿入し、不整脈の原因となる心筋組織を焼灼・修飾することによって頻脈性不整脈を根治する治療です。近年、この分野の著しく進歩を遂げており、頻脈性不整脈のほぼ全てが治療対象になります。以前は抗不整脈薬を服用し続けないといけなかった患者様も、この治療により薬物療法を中止することが可能になります。
当院では現在のアブレーション治療において必要不可欠となっている3Dマッピングシステム(CARTO3、Ensite)も完備し、他病院でまだ多く導入されていない透視と3Dマッピングシステムの統合ソフトウェア「CARTO UNIVU」も導入し、最新のアブレーション治療を行うことが可能です。
頻脈性不整脈の中でも現在、症例が増加しているのは“心房細動“という不整脈です。当院でも積極的に心房細動に対するアブレーションを行っております。平成27年からは従来行っている高周波アブレーションに加え、冷凍凝固により治療するクライオバルーンによる治療も開始しており、良好な成績が得られております。一般的に発症早期の発作性心房細動では治療成績が良く、心房細動の持続期間が長くなるにつれ治療効果が低下しますので心房細動は早期発見、早期治療が大切です。通常、アブレーションの入院期間は3泊4日で、入院費用は高額医療制度を申請していただくと10万円程度となります。
また、致死性心室性不整脈に対しては経静脈植込み型除細動器移植術、重症心不全に対して両心室ペーシング(CRT)植込み術も施行しています。平成28年からは皮下植込み型除細動器も可能となりました。徐脈のためのペーシングが不要な場合に適応となります。患者様の病状に応じて使い分けています。
平成29年よりリードレスペースメーカの植込みが可能となりました。リードやペースメーカポケットによる合併症がなくなるという大きなメリットがあります。すべての徐脈性不整脈に適応となるわけではありませんが、病状に応じて使い分けています。
|
 左心耳閉鎖デバイス WATCHMAN 左心耳閉鎖デバイス WATCHMAN
心房細動に起因する心原性脳梗塞の予防として、ほぼ必須である抗凝固薬の有用性はよく知られています。しかし、その副作用である出血のリスクも考慮しなければならず、出血リスクの高い患者さんの場合、抗凝固薬の投与を行うかどうか、判断が難しいのが現状だと思います。
左房内血栓の90%以上が左心耳内に形成されることが知られており、その左心耳を閉鎖することにより、抗凝固薬の中止を可能とするのが左心耳閉鎖デバイス(Watchman)です。
WATCHMANは、脳梗塞のリスクが高く(CHADS2≧2点)、かつ、抗凝固薬による出血のリスクも高い患者さんが適応となります。
左心耳閉鎖デバイス(Watchman)は全身麻酔下にカテーテルを用いて行います。下大静脈から心房中隔を経由し左房にアプローチし、経食道心エコーガイドで留置します。手技時間は約1時間程度です。
数か月後には内皮化され、抗凝固薬の中止が可能となります。対象かも・・と思われる患者さんがおられましたら、是非ご紹介をお願いいたします。
|
 |
 経皮的リード抜去術 経皮的リード抜去術
昨2023年からエキシマレーザーシステムを導入し、当院でもリード抜去術が可能となりました。
ペースメーカポケット部の感染やペースメーカ植込み例での菌血症などはリード抜去の適応となります。
|
 経皮的卵円孔開存閉鎖術 経皮的卵円孔開存閉鎖術
卵円孔開存(PFO: Patent Foramen Ovale)とは、右心房と左心房を分ける壁(心房中隔)に小さな孔が開いていることをいい、成人の2~3割に認められます。
脳梗塞の病態は多岐にわたりますが、原因が特定困難な塞栓源不明脳塞栓症 (潜因性脳梗塞) が近年注目されています。特に若年性 (60歳以下) の塞栓源不明脳塞栓症患者では、下肢静脈などにできた血栓が心臓に流れていき、開存している卵円孔を介して右心房から左心房へと流れ、動脈系の血管に流れていくことがあります。その血栓が脳に流れていき脳の血管が詰まってしまうと脳梗塞や一過性脳虚血発作を引き起こすことがあります。このような脳梗塞を『奇異性脳塞栓症』といいます。
経皮的卵円孔開存閉鎖術とは、右心房と左心房の壁(心房中隔)に開いているこの孔に対して、「AMPLATZER(TM)PFOオクルーダー」を留置することで、血液の右心房と左心房の交通をなくし、奇異性脳梗塞の再発を予防します。
|
|
■心エコー図検査の現場
■経胸壁心エコー図検査
■経食道心エコー図検査 |  心臓超音波検査(心エコー図検査) 心臓超音波検査(心エコー図検査)
超音波検査は、体表面に当てた探触子と呼ばれる装置から超音波を体内に向けて照射し、組織から反射して返ってきた超音波を再び探触子で捉え、その信号を解析することで臓器を画像化する検査です。
心エコー図検査では、心臓の形や大きさ、動きや働きを診断することができます。超音波は体に無害なので、患者さんに対する負担が少ない非侵襲的検査であるうえに、機械さえ運べばどこでも行うことができる機動性に優れた検査です。その診断能力は高く、ほとんど全ての心臓病の治療前後に必要です。特に弁膜症や心不全においては、最終診断のために用いられる重要な検査です。さて、当センターでは、通常の心エコー図検査のみならず、さらに高度な診断に用いる負荷心エコー図検査や三次元心エコー図検査、経食道心エコー図検査等を駆使して、より正確で詳細な診断を行うようにしています。日々の検査においては、医師と検査技師、看護士で協力しながら円滑に行えるように努力しています。また、学会活動や研究・教育活動にも積極的に取り組み、より正しい知識と技術で検査を行えるように心がけています。
※心エコー・グループでは、新しいメンバー(医師、技師を問わず)を随時募集しております。あなたの力が必要です。是非仲間になってください。
|
 当センターの心エコー・グループから発信した主な研究論文 当センターの心エコー・グループから発信した主な研究論文
- Abe Y, et al. Relation between reduction in ischaemic mitral regurgitation and improvement in regional left ventricular contractility during low dose dobutamine stress echocardiography. Heart. 2005;91:1092-3.
- Abe Y, et al. Intravenous myocardial contrast echocardiography predicts regional and global left ventricular remodelling after acute myocardial infarction: comparison with low dose dobutamine stress echocardiography.Heart. 2005;91:1578-83.
- Abe Y, et al. A novel echocardiographic index of inefficient left ventricular contraction resulting from mechanical dyssynchrony. J Cardiol. 2010;55:248-55.
- Furukawa A, et al. Comparison of two-dimensional and real-time three-dimensional transesophageal echocardiography in the assessment of aortic valve area. J Cardiol. 2012;59:337-43.
- Yagishita-Tagawa Y, et al. Low-dose dobutamine induces left ventricular mechanical dyssynchrony in patients with dilated cardiomyopathy and a narrow QRS: A study using real-time three-dimensional echocardiography. J Cardiol. 2013;61:275-80.
- Abe Y, et al. A novel and simple method using pocket-sized echocardiography to screen for aortic stenosis. J Am Soc Echocardiogr. 2013;26:589-96.
- Takahashi Y, et al. Mitral valve repair for atrial functional mitral regurgitation in patients with chronic atrial fibrillation. Interact Cardiovasc Thorac Surg. 2015;21:163-8.
- Furukawa A, et al. Prediction of aortic stenosis-related events in patients with systolic ejection murmur using pocket-sized echocardiography. J Cardiol 2017; 69: 189-194.
- Abe Y, et al. Pre-Load-Induced Changes in Forward LV Stroke and Functional Mitral Regurgitation: Echocardiographic Detection of the Descending Limb of Starling's Curve. JACC Cardiovasc Imaging 2017; 6: 611-8.
- Ito K, et al. Mechanism of atrial functional mitral regurgitation in patients with atrial fibrillation: A study using three-dimensional transesophageal echocardiography. J Cardiol. 2017; 70: 584-590.
- Abe Y, et al. Prevalence and Prognostic Significance of Functional Mitral and Tricuspid Regurgitation Despite Preserved Left Ventricular Ejection Fraction in Atrial Fibrillation Patients. Circ J. 2018; 82: 1451-8.
- Morishita M, et al. Myocardial oedema lesion with echocardiography in a patient with cardiac sarcoidosis. Eur Heart J Cardiovasc Imaging. 2019; 20: 437.
- Hayashi H, et al. The Accuracy of a Large V Wave in the Pulmonary Capillary Wedge Pressure Waveform for Diagnosing Current Mitral Regurgitation. Cardiology 2018; 141: 46-51.
- Furukawa A, et al. Mechanisms of changes in functional mitral regurgitation by preload alterations. J Cardiol. 2018; 71: 570-6.
- Ito K, et al. Prognostic significance of residual functional mitral regurgitation in hospitalized heart failure patients with chronic atrial fibrillation and preserved ejection fraction after medical therapies. J Echocardiogr. 2019; 17: 197-205.
- Hayashi H, et al. Impact of stroke volume on prognostic outcome in patients with atrial fibrillation and concomitant heart failure with preserved ejection fraction. J Cardiol. 2019; 73: 307-12.
- Abe Y, et al. Anomalous fibromuscular cord of the left atrium. Eur Heart J Cardiovasc Imaging. 2020;21:1143.
- Abe Y, et al.Assessing the true severity of low-gradient aortic stenosis using resting echocardiography. J Cardiol. 2021;77:327-33.
- Akamatsu K, et al. Etiology of atrial functional mitral regurgitation: insights from transthoracic echocardiography in 159 consecutive patients with atrial fibrillation and preserved left ventricular ejection fraction. Cardiology. 2020;145:511-21.
- Takahashi Y, et al. Mid-term results of valve repairs for atrial functional mitral and tricuspid regurgitations.Gen Thorac Cardiovasc Surg. 2020;68:467-76.
- Hayashi H, et al. Prognostic significance of moderate primary mitral regurgitation and concomitant paroxysmal atrial fibrillation. J Cardiol. 2020;75:309-14.
- Abe Y, et al. Rare murmur in a patient with constrictive pericarditis. Cardiol J. 2021;28:500-1.
- Abe Y, et al. Functional mitral regurgitation, updated: ventricular or atrial? J Echocardiogr. 2020;18:1-8.
- Abe Y, et al. Looking into the mechanistic link between mitral regurgitation and atrial fibrillation. Cardiol Clin. 2021;39:281-8.
- Abe Y, et al. A new disease entity: atrial functional mitral regurgitation. J Cardiol. 2021;77:565-9.
- Furukawa A, et al. Simple echocardiographic scoring in screening aortic stenosis with focused cardiac ultrasonography in the emergency department. J Cardiol. 2021;77:613-9.
- Abe Y, et al. Screening for aortic stenosis using physical examination and echocardiography. J Echocardiogr. 2021;19:80-85.
- Kagawa S, et al. The impact of aorto-mitral angle on new-onset atrial arrhythmia after mitral valve repair in patients with mitral regurgitation. Int Heart J. 2021;62:1273-9.
 冠動脈CT検査 冠動脈CT検査
近年、冠動脈CT検査によって心臓カテーテルを行わずに冠動脈の評価が可能となり、冠動脈狭窄の早期発見が可能となりました。当院では2007年4月より冠動脈CT検査を行っており、腕の静脈から造影剤を点滴しながらCT撮影することで、外来でより安全に冠動脈の検査を行うことができます。さらに当院は2016年3月にSiemens社のSOMATOM Forceという最新のCT装置を大阪府内で最初に導入しました。このCT装置は次世代2管球搭載型のCT装置で従来のものと比べて画質が改善しただけでなく、圧倒的な短時間の撮影と被ばく量や造影剤使用量の低減が期待できます。このCT装置を用いることで患者さんの身体により負担の少ない冠動脈検査が可能となりました。また、冠動脈CT検査は心臓カテーテル検査ではわからない血管壁の性状(プラークや石灰化の有無)に関する情報も得ることができます。冠動脈CT検査で異常があれば、患者さんのご都合に合わせて入院していただき、心臓カテーテル検査をして狭窄部位を治療することになります。このCT検査を受けて頂くのは以下のような方がおすすめです。労作時の胸痛、息切れ、動悸を有する方、何らかの胸部症状がある方、無症状であっても糖尿病、高血圧、脂質異常症、肥満、メタボリック症候群などを指摘されている方、長年喫煙をされている方、ご両親ご兄弟に心臓病の既往がある方などです。希望される方は、まずは当院循環器内科外来を受診してください(初診の方は11時までに来院してください)。外来で冠動脈CT検査の説明をして検査予約をさせて頂きます。
■冠動脈CT
|
 FFR-CT FFR-CT
冠動脈疾患の治療の必要性を判断するにあたり、“見た目の狭窄度”ではなく、”狭窄部位がもたらす心筋への血液供給の低下”が重要であり、この心筋虚血を機能的に評価することが求められています。カテーテル検査の際に、プレッシャーワイヤーを用いた「冠血流予備量比 (Fractional Flow Reserve: FFR)」を計測することが臨床で増えてまいりましたが、冠動脈内にワイヤーの挿入を要するため、患者さんにとって侵襲的負担になることもありました。
今回当院で導入したFFR-CTでは、カテーテル検査を行うことなく、冠動脈CTの画像データからFFR値を測定することを可能にしたテクノロジーで、流体力学に基づいたコンピューターによる高度な血流シミュレーションを行うことで、機能的虚血があるかどうかを推定することができます。
冠動脈CT検査の画像のみを使用するため、カテーテルを用いた侵襲的検査は必要ないだけでなく、追加のCT撮影も必要ありません。この方法により、本来カテーテル検査が必要だった患者さんがCT検査のみで適切に治療方法を選択することが可能になります。その結果、入院検査を省くことができるだけでなく、治療の要否判定をわかりやすい結果で提供できうると期待されています。
|
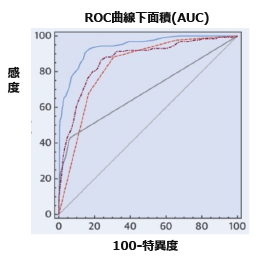
 心臓検査の診断性能 心臓検査の診断性能
FFR-CT(青)とPET(茶)、冠動脈CT(橙)、SPECT(黒) の診断能について直接比較し、FFR-CTは他の非侵襲的検査よりも優れた診断能を示した。
(J Am Coll Cardiol 2019; 73: 161-73)
|
|
 心臓MRI 心臓MRI
MRI検査は磁気を用いて得られる信号をコンピュータで画像化する検査であり、放射線を用いないので被ばくの心配はありませんが、一方で心臓のような動きのある部位の検査には不向きで、身体の中の動きのない部位(脳神経・脊髄、腹部・骨盤領域、四肢など)に限られる検査でした。近年、MRI装置の進歩により心臓病領域におけるMRI検査(=心臓MRI)が可能となり、その有用性が注目されています。特に造影剤を用いた心臓MRIでは心筋症(心サルコイドーシスや心アミロイドーシスなど)における原因疾患の鑑別で非常に重要や情報が得られます。これまで主に心臓核医学検査で行われてきた心筋梗塞部位の生存性についてもその程度や範囲の評価が可能です。また、心臓超音波検査の画像は体格や骨などに影響を受けるため、個々の患者さんによって画質が異なりますが、心臓MRIはそれらの影響が無いので、心臓の形態や大きさ、動きなどを評価するのに適しています。心臓内の血栓や腫瘍などの評価にも非常に有用です。最近、MRI検査対応のペースメーカが使用されるようになってきており、MRI対応の機種が植え込まれている方では心臓MRIも撮影することが可能です(画像)。今後の課題として、検査時間が40~50分程度必要であることや腎機能障害のある方では造影MRI検査ができないことなどがありますが、心臓病領域において非常に重要な検査となると期待されています。 |
■CMR
|
 |
 心臓リハビリテーション 心臓リハビリテーション
心臓リハビリテーションは1970年代には「身体デコンディショニングを是正し社会復帰を迅速かつ安全に実現する短期的介入」と認識されていました。しかし、その後多数のエビデンスが蓄積され、現在では心臓リハビリテーションは単なる体力回復訓練や単なる冠危険因子改善介入ではなく、「多面的効果により心疾患患者の予後とQOLの改善を目指す長期的介入」と認識されるようになりました。現在では急性心筋梗塞症や慢性心不全治療のガイドラインにおいて推奨されています。当院でも2006年7月に施設基準を取得し心臓リハビリテーションを開始しました。
現在1日2-3名の急性心筋梗塞症患者さんや心臓外科術後の患者さんを中心に心臓リハビリテーションを行っています。今後、外来に通院されている患者さんの心臓リハビリテーションも積極的に行い、再発の予防に努めていきたいと思います。 |
 大阪心不全地域医療連携の会(Osaka Stops HEart Failure,OSHEF) 大阪心不全地域医療連携の会(Osaka Stops HEart Failure,OSHEF)
北野病院と当院、近隣のクリニックの先生方で協力し、2017年に始めたOSHEF。今や大阪市北部のみならず市全体あるいは府全体にまでOSHEFの輪が広がりつつあります。高齢化社会で増え続ける心不全患者の心不全再入院を防ぐのが第1目的です。3つのツールを使うこと(図1)、心不全ポイントにしたがった早期受診行動をとっていただくこと(図2)が本会の特徴です。当院におけるワークフロー(図3)と現在までのクリニカルパス導入患者数(図4)を示しました。どうぞ今後ともご協力をお願い申し上げます。
|
|